수소 결합
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
수소 결합은 전기음성도가 큰 원자에 결합된 수소 원자와 다른 분자의 전기음성도가 큰 원자 사이에서 형성되는 분자 간 상호 작용이다. IUPAC은 X-H···Y 형태로 표기하며, 여기서 점선은 수소 결합을 나타낸다. 수소 결합은 정전기적 쌍극자-쌍극자 상호작용으로 설명되지만, 공유 결합의 성질도 일부 가지며, 결합 강도는 약한 것부터 매우 강한 것까지 다양하다. 물, 플루오린화 수소, 암모니아, 에탄올 등 다양한 물질에서 나타나며, 물의 특성, DNA의 염기 간 결합, 단백질의 구조 형성 등 생명 현상과 물질의 특성에 중요한 영향을 미친다. 또한, 약물 설계에도 중요한 요소로 작용한다.
더 읽어볼만한 페이지
- 분자간 힘 - 소수성
소수성은 물을 기피하는 성질로, 생물학, 화학 등 다양한 분야에서 중요하게 다루어지며, 미셀 형성, 단백질 구조 형성, 초소수성 현상 등과 관련되어 자가 세척, 랩온어칩, 제약 분야 등에 응용된다. - 분자간 힘 - 반데르발스 힘
반데르발스 힘은 원자, 분자, 표면 간에 작용하는 인력으로, 입자들의 변동하는 극성화 상관관계에서 발생하며, 영구 다극자, 유도된 다극자, 순간 다극자 간 상호작용의 총합으로, 공유결합이나 이온결합보다 약하지만 물질의 물리적·화학적 특성, 생체 분자 상호작용, 도마뱀붙이의 벽면 부착 등에 중요한 역할을 한다. - 수소물리학 - 보어 모형
보어 모형은 닐스 보어가 러더퍼드 모형의 한계를 극복하기 위해 양자 개념을 도입하여 전자의 궤도와 각운동량이 양자화된다는 가정으로 수소 원자의 스펙트럼을 설명했지만, 다전자 원자와 불확정성 원리의 모순으로 양자역학에 의해 대체된 원자 모형이다. - 수소물리학 - 수소 이온
수소 이온(H⁺)은 양성자와 같지만 수용액에서 물 분자와 결합하여 다양한 수화 이온을 형성하고, pH 농도 측정과 산-염기 반응, 전기 전도도, 생명체의 에너지 생산 등 다양한 현상과 관련이 있다. - 초분자화학 - 이온 결합
이온 결합은 금속 양이온과 비금속 음이온 간의 정전기적 인력에 의해 형성되며, 산화 환원 반응을 통해 생성되어 결정 격자 구조를 가지며, 전기 음성도 차이가 클수록 이온성이 강해진다. - 초분자화학 - 소수성 효과
2. 결합
수소 결합은 전기음성도가 큰 원자에 결합된 수소 원자(수소 결합 주개)와 다른 분자의 전기음성도가 큰 원자(수소 결합 받개) 사이에서 형성되는 강한 분자간 인력이다. IUPAC은 수소 결합을 "X-H···Y" 형태로 표기하며, 여기서 점선(···)은 수소 결합을 나타낸다. (X는 수소보다 전기음성도가 큰 원자)[5]
수소 결합은 정전기적 쌍극자-쌍극자 상호작용으로 설명되지만, 공유 결합의 성질도 일부 가지고 있어 방향성과 강한 힘을 나타낸다. 수소 결합의 세기는 약한(1-2 kJ/mol) 것부터 매우 강한 것(161.5 kJ/mol)까지 다양하며,[17][18] 결합 길이는 결합 강도, 온도, 압력에 따라 달라진다. 물 속의 수소 결합의 전형적인 길이는 197pm이다.
일반적인 수소 결합의 엔탈피는 다음과 같다:[19]
- F−H···:F (161.5 kJ/mol)
- O−H···:N (29 kJ/mol)
- O−H···:O (21 kJ/mol)
- N−H···:N (13 kJ/mol)
- N−H···:O (8 kJ/mol)
- HO−H···:OH3+ (18 kJ/mol)[20]
수소 결합의 각도는 수소 결합 주개의 특성에 따라 달라진다. 다음 표는 플루오린화 수소산과 다양한 수용체 사이의 수소 결합 각도를 나타낸다.[24]
2. 1. 약한 수소 결합
N, O, F 이외의 원자가 주개나 받개로 참여하거나, 수소와 비슷한 전기음성도를 가진 원자가 참여하는 경우 약한 수소 결합이 형성될 수 있다. C-H 결합도 특정 조건(탄소가 전기음성도가 큰 원자에 결합된 경우)에서 약한 수소 결합에 참여할 수 있는데, 예를 들어 클로로포름(CHCl3), 알데하이드, 말단 아세틸렌 등이 이에 해당한다.[14][15]약한 수소 결합은 N, O, F 이외의 원소, 또는 수소와 전기음성도가 비슷한 원소 사이에서도 일어난다. 황(S)이나 염소(Cl)도 수소와 결합하여 약한 수소 결합을 형성할 수 있다.[13] 이러한 "비전통적인" 수소 결합 상호작용은 약하지만(≈1 kcal/mol) 다양한 재료의 구조에 영향을 미친다.
IUPAC은 2011년에 수소 결합에 대한 현대적인 정의를 제시했다. 이 정의에 따르면, 수소 결합은 X-H (X는 H보다 전기음성도가 큰 원자)의 수소 원자와 다른 분자의 원자 또는 원자 그룹 사이에 작용하는 인력이다.[16]
탄소 원자에 결합된 수소 원자도 탄소가 전기음성도가 큰 원자와 결합하고 있는 경우에는 수소 결합에 참여할 수 있다. 부분적인 양전하를 띠는 수소 원자는 큰 전하 밀도를 나타내고, 이는 헤테로 원자의 비공유 전자쌍을 끌어당겨 수소 결합을 형성한다.
수소 결합은 정전기적 상호작용 외에도 공유 결합적인 성질도 일부 가지고 있다. 지향성이 강하고, 반 데르 발스 반지름보다 짧은 원자간 거리를 가지며, 제한된 수의 상호작용만을 형성한다.
2. 2. 공명 보조 수소 결합 (RAHB)
'''공명 보조 수소 결합'''(Resonance-assisted hydrogen bond, RAHB)은 강한 수소 결합의 한 형태이다. 이는 수소를 포함하는 π-비편재화로 특징지어지며, 전기적 모델만으로는 제대로 설명할 수 없다. 이 수소 결합은 O=C-OH*영어 또는 *O=C-C=C-OH영어 사이에서 관찰되는 유난히 짧은 거리를 설명하기 위해 제안되었다.[23]3. 역사
라이너스 폴링은 1912년 T. S. 무어와 T. F. 윈밀이 수소 결합을 처음 언급했다고 평가했다.[38][39] 무어와 윈밀은 수산화트리메틸암모늄이 수산화테트라메틸암모늄보다 약한 염기임을 설명하기 위해 수소 결합을 사용했다. 몇 년 후인 1920년 라티머와 로데부시는 물에서 수소 결합에 대한 설명을 제시했다.[40] 이들은 논문에서 연구소 동료 과학자인 모리스 로열 허긴스의 연구를 인용하며, "본 연구소의 허긴 씨는 아직 발표되지 않은 일부 연구에서 두 개의 원자 사이에 있는 수소 커널에 대한 아이디어를 특정 유기 화합물에 대한 이론으로 사용했다"라고 밝혔다.
4. 수소 결합이 나타나는 예
물, 플루오린화 수소(HF), 암모니아(NH3), 에탄올(C2H5OH), 메탄올(CH3OH), 아세트산(CH3COOH) 등은 수소 결합을 형성한다. 특히 플루오린화 수소와 아세트산은 수소 결합을 통해 이합체를 형성하기도 한다.
DNA의 염기간 결합, 단백질의 2차 및 3차 구조, 포도당, 설탕, 녹말 등 많은 생체 분자에서도 수소 결합이 나타난다.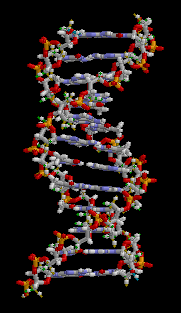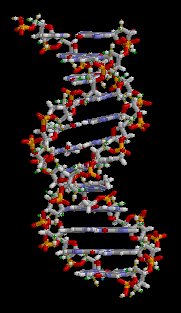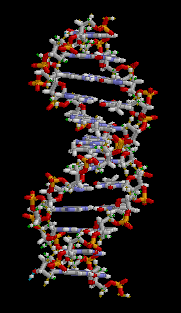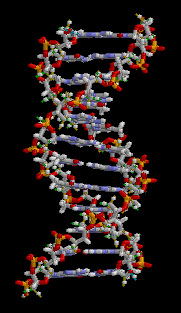
DNA의 이중 나선 구조는 주로 염기쌍 간의 수소 결합(및 파이 스태킹 상호 작용)에 기인하며, 이는 상보적인 가닥을 서로 연결하고 DNA 복제를 가능하게 한다. 단백질의 이차 구조에서는 주쇄의 산소 원자와 아미드 결합의 수소 원자 사이에서 수소 결합이 형성된다.
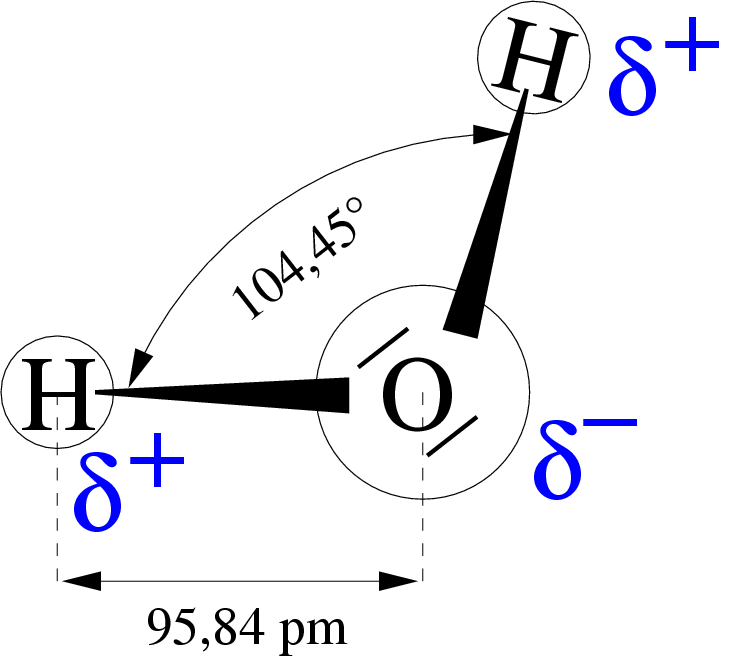
4. 1. 물(H₂O)의 수소 결합
물 분자는 굽은형 구조를 가지며, 산소 원자는 부분적인 음전하를, 수소 원자는 부분적인 양전하를 띤다. 이러한 극성으로 인해 물 분자 간에는 강한 정전기적 인력이 발생하여 수소 결합을 형성한다. 물 분자 간의 수소 결합('''H-O-H···O-2H''' 형태)은 다른 분자 간 결합보다 강한 결합력을 나타내어, 많은 에너지가 필요하기 때문에 끓는점, 어는점이 높아진다.[30][31][32]
수소 결합으로 인해 물은 많은 양의 열을 저장할 수 있어 비열과 열용량이 크다. 이는 지구 생태계를 유지하고, 바닷가에서 해풍과 육풍을 발생시키는 역할을 한다. 바다는 육지보다 비열이 커서 온도 변화가 적으므로, 낮에는 육지가 빨리 가열되어 해풍이 불고, 밤에는 육지가 빨리 냉각되어 육풍이 분다.
물의 수소 결합은 얼음이 될 때 빈 공간이 많은 육각고리 모양의 결정을 형성하여 부피는 증가하고 밀도는 감소하게 한다. (일반적으로는 액체 상태 물질의 밀도보다 고체 상태의 물질의 밀도가 훨씬 크다) 이러한 특성 덕분에 영하의 기온에서도 호수 속 물고기들이 생존할 수 있다.
수소 결합은 물의 표면 장력을 강하게 만들어 모세관 현상과 같은 현상을 일으킨다.
4. 2. 이합체
플루오린화 수소(HF)와 아세트산(CH3COOH) 등의 몇몇 분자들은 수소 결합을 통해 두 분자가 한 분자처럼 행동하는 이합체를 형성한다.4. 3. 기타 액체
암모니아는 수소 원자는 세 개지만 비공유 전자쌍은 하나뿐이어서 수소 결합 형성에 제한이 있다.[64] 플루오린화 수소는 F 원자에 세 쌍의 비공유 전자쌍이 있지만 수소 원자가 하나뿐이어서 두 개의 수소 결합만 형성할 수 있다.[64]:
5. 고분자에서의 수소 결합
DNA의 이중 나선 구조는 주로 염기쌍 간의 수소 결합에 의해 유지되며, 이는 DNA 복제를 가능하게 한다. 단백질의 이차 구조는 주쇄 산소와 아미드 수소 사이의 수소 결합에 의해 형성된다. 아미노산 잔기 간격에 따라 알파 나선이나 310 나선이 형성되고, 두 가닥이 번갈아 가며 수소 결합으로 연결되면 베타 시트가 형성된다.
셀룰로스, 나일론, 아라미드 섬유 등은 사슬 간 또는 사슬 내 수소 결합에 의해 강도가 높아진다. 특히 나일론의 경우, 카보닐기와 아미드기의 수소 결합은 인접한 사슬을 연결하여 재료의 강도를 높인다. 아라미드 섬유는 수소 결합이 선형 사슬을 측면으로 안정화시켜 매우 뻣뻣하고 강하게 만든다.
하지만, 이러한 수소 결합 네트워크는 물 분자가 확산되어 결합을 방해할 수 있기 때문에 습도에 민감하다.
5. 1. 분지형 수소 결합
하나의 수소 원자가 두 개의 수소 결합에 참여할 수 있는 경우를 분지형 수소 결합이라고 한다. 예를 들어, 복잡한 유기 분자에서 나타날 수 있다.[46] 분지형 수소 결합은 물의 재배열 과정에서 중요한 역할을 하는 것으로 알려져 있다.[47]수용체형 수소 결합(산소의 비공유 전자쌍에서 끝나는 결합)은 공여체형 수소 결합(같은 산소 원자의 수소에서 시작하는 결합)보다 분지(과배위 산소, OCO)를 형성하기 쉽다.[48]
6. 대칭 수소 결합
대칭 수소 결합은 양성자가 두 개의 동일한 원자 사이의 정확히 중간 지점에 위치하는 특별한 유형의 수소 결합이다. 각 원자에 대한 결합의 세기는 동일하다. 이는 3중심 4전자 결합의 한 예이다. 이러한 유형의 결합은 "일반적인" 수소 결합보다 훨씬 강하다. 유효 결합 차수는 0.5이므로 강도는 공유 결합과 유사하다. 고압 얼음, 고압 플루오린화 수소산 및 개미산과 같은 많은 무수산의 고체상에서 관찰된다.[54] 이플루오르화물 이온 [F-H-F]−에서도 관찰된다. 대칭 수소 결합은 최근 고압 (> GPa) 하의 포름산에서 분광학적으로 관찰되었다.
7. 이수소 결합
디수소 결합은 수소 원자를 포함하는 분자간 결합 상호작용의 일종으로, 수소 결합과 비교될 수 있다. 이러한 구조는 결정학에 의해 잘 특성화되어 왔지만,[56] 전통적인 수소 결합, 이온 결합, 공유 결합과의 관계에 대한 이해는 여전히 불분명하다. 일반적으로 수소 결합은 비금속 원자(특히 질소족 및 칼코겐 그룹)의 고립 전자쌍인 양성자 수용체로 특징지어진다. 어떤 경우에는 이러한 양성자 수용체가 파이 결합 또는 금속 착물일 수 있다. 그러나 디수소 결합에서는 금속 수소화물이 양성자 수용체 역할을 하여 수소-수소 상호작용을 형성한다. 중성자 회절은 이러한 착물의 분자 기하학이 수소 결합과 유사하며, 결합 길이가 금속 착물/수소 공여체 시스템에 매우 적응 가능하다는 것을 보여주었다.[56]
8. 확인하는 방법
적외선 흡수 스펙트럼을 이용하여 X-H···Y기에서 '''X-H'''기의 신축 진동 변화를 확인하여 수소 결합을 확인할 수 있다.
강한 수소 결합은 1H NMR 스펙트럼에서 저자기장 이동으로 나타난다. 예를 들어, 아세틸아세톤의 엔올 호변이성체에 있는 산성 양성자는 δ|H영어 15.5에서 나타나는데, 이는 일반적인 알코올보다 약 10 ppm 저자기장이다.[25]
IR 스펙트럼에서 수소 결합은 X-H 신축 진동수를 더 낮은 에너지(즉, 진동수가 감소)로 이동시킨다. 이러한 이동은 X-H 결합의 약화를 반영한다. 특정 수소 결합(부적절한 수소 결합)은 X-H 신축 진동수의 청색 이동과 결합 길이의 감소를 보인다.[26] H-결합은 또한 수용체의 IR 진동 모드 이동으로 측정할 수 있다. α-나선에서 백본 카르보닐의 아미드 I 모드는 측쇄 히드록실 그룹과 H-결합을 형성할 때 더 낮은 주파수로 이동한다.[27] 물에서 수소 결합 구조의 역학은 이 OH 신축 진동으로 조사할 수 있다.[28] 녹기 전 고체-고체 상전이를 나타내는 위상 변화 물질의 일종인 양성자성 유기 이온성 플라스틱 결정(POIPC)의 수소 결합 네트워크에서 가변 온도 적외선 분광법은 수소 결합의 온도 의존성과 음이온과 양이온의 역학을 모두 밝힐 수 있다.[29] 고체-고체 상전이 동안 수소 결합의 갑작스러운 약화는 이온의 배향 또는 회전 무질서의 시작과 관련이 있는 것으로 보인다.[29]
9. 이론적 고찰
수소 결합은 분자간 고립 전자쌍 ":" 비결합과 분자내 극성 공유 결합을 반발 결합과 통합하여 설명할 수 있다.[31]
관련된 잔기 간 포텐셜 상수(강성 상수)에 대한 양자 화학적 계산 결과, 동일한 유형의 개별 H 결합 간에 큰 차이가 나타났다. 예를 들어, 구아닌과 시토신 사이의 중심 잔기 간 수소 결합은 아데닌-티민 쌍 사이의 결합에 비해 훨씬 더 강하다.[32]
이론적으로, 수소 결합의 결합 강도는 비공유 상호 작용 지수(NCI 지수)를 사용하여 평가할 수 있으며, 이 지수를 통해 시스템의 전자 밀도를 사용하여 이러한 비공유 상호 작용을 시각화할 수 있다.
컴프턴 산란 실험 결과는 수소 결합이 부분적으로 공유 결합이라는 것을 보여준다.[33]
10. 응용
수소 결합은 약물 설계와 관련이 있다. 리핀스키의 5의 규칙에 따르면, 경구 투여 활성 약물의 대부분은 5개 이하의 수소 결합 공여체와 10개 미만의 수소 결합 수용체를 가진다. 이러한 상호 작용은 질소–수소 및 산소–수소 중심 사이에 존재한다.[57] 그러나 많은 약물들이 이러한 "규칙"을 따르지 않는다.[58]
참조
[1]
논문
Mapping the force field of a hydrogen-bonded assembly
[2]
논문
Mechanism of high-resolution STM/AFM imaging with functionalized tips
2014-08-19
[3]
논문
Binding and Release between Polymeric Carrier and Protein Drug: pH-Mediated Interplay of Coulomb Forces, Hydrogen Bonding, van der Waals Interactions, and Entropy
https://doi.org/10.1[...]
2017
[4]
논문
Intermolecular Contrast in Atomic Force Microscopy Images without Intermolecular Bonds
http://dspace.librar[...]
2017-08-30
[5]
논문
Definition of the hydrogen bond (IUPAC Recommendations 2011)
2011-07-08
[6]
서적
The Hydrogen Bond
Franklin Classics
[7]
서적
An introduction to hydrogen bonding
Oxford university press New York
[8]
서적
Hydrogen bonding in biological structures
Springer: Berlin
[9]
간행물
hydrogen bond
[10]
논문
The Hydrogen Bond in the Solid State
[11]
논문
Hydrogen bonds involving sulfur. I. Hydrogen sulfide dimer
[12]
논문
Self-Complementarity Achieved through Quadruple Hydrogen Bonding
[13]
서적
The Weak Hydrogen Bond: In Structural Chemistry and Biology, International Union of Crystallography
[14]
서적
The CH–π Interactions
Wiley-VCH, New York
[15]
논문
The CH/[small pi] hydrogen bond in chemistry. "Title
[16]
논문
Definition of the hydrogen bond
[17]
논문
Gas-phase bihalide and pseudobihalide ions. An ion cyclotron resonance determination of hydrogen bond energies in XHY- species (X, Y = F, Cl, Br, CN)
[18]
논문
Very Strong Hydrogen Bonds
[19]
간행물
Advances in Chromatography Volume 54
CRC Press, Boca Raton
[20]
논문
Structure and energetics of the hydronium hydration shells
http://www.fh.huji.a[...]
2017-10-25
[21]
논문
Experimental Binding Energies in Supramolecular Complexes
2016-05
[22]
논문
Fundamental Properties of the CH···O Interaction: Is It a True Hydrogen Bond?
1999
[23]
논문
The Origin of the Non-Additivity in Resonance-Assisted Hydrogen Bond Systems
[24]
논문
Angular geometries and other properties of hydrogen-bonded dimers: a simple electrostatic interpretation of the success of the electron-pair model
[25]
서적
Basic One- and Two- Dimensional NMR Spectroscopy, 4th ed.
VCH: Weinheim
[26]
논문
Blue-Shifting Hydrogen Bonds
[27]
논문
Strength of a bifurcated H bond
[28]
논문
Ultrafast memory loss and energy redistribution in the hydrogen bond network of liquid H2O
[29]
논문
1,2,4-Triazolium perfluorobutanesulfonate as an archetypal pure protic organic ionic plastic crystal electrolyte for all-solid-state fuel cells
https://semanticscho[...]
[30]
논문
What is a hydrogen bond? Resonance covalency in the supramolecular domain
[31]
서적
The Attribute of Water: Single Notion, Multiple Myths
Springer
[32]
논문
Direct Assessment of Interresidue Forces in Watson−Crick Base Pairs Using Theoretical Compliance Constants
[33]
논문
Covalency of the Hydrogen Bond in Ice: A Direct X-Ray Measurement
[34]
논문
Is the Hydrogen Bond in Water Dimer and Ice Covalent?
2000-02-01
[35]
논문
Ab initio calculations of the hydrogen bond
2002
[36]
논문
Observation of through-hydrogen-bond (2h)J(HC') in a perdeuterated protein
[37]
논문
Hydrogen bonding: Homing in on a tricky chemical concept
[38]
서적
The nature of the chemical bond and the structure of molecules and crystals; an introduction to modern structural chemistry
https://archive.org/[...]
Cornell University Press
[39]
논문
The state of amines in aqueous solution
[40]
논문
Polarity and ionization from the standpoint of the Lewis theory of valence
https://zenodo.org/r[...]
[41]
웹사이트
11.9: Water - An Extraordinary Substance
https://chem.librete[...]
2017-06-29
[42]
논문
Temperature and size dependence for Monte Carlo simulations of TIP4P water
[43]
논문
Structural properties of water: Comparison of the SPC, SPCE, TIP4P, and TIP5P models of water
[44]
논문
Hydrogen Bonding between Solutes in Aqueous Solution
[45]
서적
Biophysics: A Physiological Approach
https://books.google[...]
Cambridge University Press
[46]
논문
Hétérocycles à fonction quinone. V. Réaction anormale de la butanedione avec la diamino-1,2 anthraquinone; structure cristalline de la naphto \2,3-f] quinoxalinedione-7,12 obtenue
[47]
논문
A Molecular Jump Mechanism for Water Reorientation
[48]
논문
The Distribution of Acceptor and Donor Hydrogen-Bonds in Bulk Liquid Water
[49]
서적
Hydrogen Bonding in Polymer Materials
Wiley-VCH
[50]
논문
Enthalpically driven peptide stabilization by protective osmolytes
[51]
논문
Unraveling the Molecular Mechanism of Enthalpy Driven Peptide Folding by Polyol Osmolytes
[52]
논문
A hydrogen-bonding network in mammalian sorbitol dehydrogenase stabilizes the tetrameric state and is essential for the catalytic power
December 2007
[53]
논문
Inhibitor design by wrapping packing defects in HIV-1 proteins
June 2004
[54]
문서
Aerobic Oxidation of Alcohols by Copper Complexes Bearing Redox-Active Ligands with Tunable H-Bonding
https://doi.org/10.1[...]
[55]
논문
'[NHN]+ Hydrogen Bonding in Protonated 1,8-Bis(dimethylamino)-2,7-dimethoxynaphthalene. X-ray Diffraction, Infrared, and Theoretical ab Initio and DFT Studies'
2005-03-01
[56]
논문
A New Intermolecular Interaction: Unconventional Hydrogen Bonds with Element-Hydride Bonds as Proton Acceptor
[57]
논문
Lead- and drug-like compounds: the rule-of-five revolution
December 2004
[58]
논문
A 'rule of 0.5' for the metabolite-likeness of approved pharmaceutical drugs
[59]
논문
Self-Complementarity Achieved through Quadruple Hydrogen Bonding
[60]
간행물
hydrogen bond
[61]
웹사이트
Definition of the Hydrogen Bond
http://media.iupac.o[...]
2011-03-13
[62]
웹사이트
Definition of the hydrogen bond
http://media.iupac.o[...]
2011-11-10
[63]
서적
The Weak Hydrogen Bond: in Structural Chemistry and Biology
Oxford Univ. Press
[64]
서적
Biology: Exploring Life
http://www.phschool.[...]
Pearson Prentice Hall
[65]
논문
Very Strong Hydrogen Bonds
[66]
논문
Structure and energetics of the hydronium hydration shells
[67]
논문
[68]
논문
CLXXVII.—The state of amines in aqueous solution
[69]
논문
Polarity and ionization from the standpoint of the lewis theory of valence
[70]
논문
Temperature and size dependence for Monte Carlo simulations of TIP4P water
[71]
논문
Structural properties of water: Comparison of the SPC, SPCE, TIP4P, and TIP5P models of water
[72]
논문
Hétérocycles à fonction quinone. V. Réaction anormale de la butanedione avec la diamino-1,2 anthraquinone; structure cristalline de la naphto [2,3-f] quinoxalinedione-7,12 obtenue
[73]
논문
A Molecular Jump Mechanism for Water Reorientation
[74]
논문
The Distribution of Acceptor and Donor Hydrogen-Bonds in Bulk Liquid Water
[75]
논문
A New Intermolecular Interaction: UnconventionalHydrogen Bonds with Element−Hydride Bonds as ProtonAcceptor
[76]
논문
Covalency of the Hydrogen Bond in Ice: A Direct X-Ray Measurement
[77]
논문
Direct Observation of Hydrogen Bonds in Nucleic Acid Base Pairs by Internucleotide 2''J''NN Couplings
[78]
논문
Observation of through-hydrogen-bond 2h''J''HC‘ in a perdeuterated protein
[79]
논문
Direct Observation of Hydrogen Bonds in Proteins by Interresidue 3h''J''NC‘ Scalar Couplings
[80]
웹사이트
Law-breaking liquid defies the rules
http://physicsworld.[...]
2004-09-24
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com




